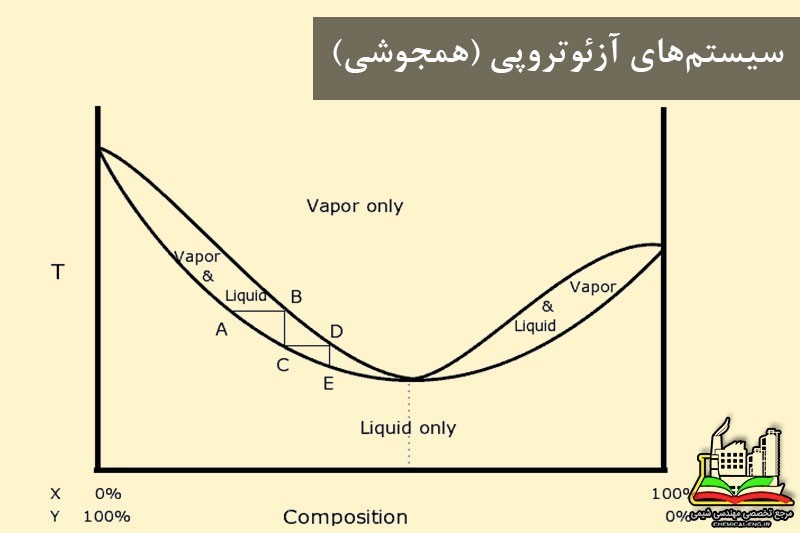
سیستم های آزئوتروپی
در برخی موارد که فشار بخار دو ماده سازنده تفاوت زیادی با هم ندارند با منحنی تعادل سر و کار داریم که در این منحنی ها در یک نقطه ترکیب درصد فازهای بخار و مایع با هم برابر هستند (\(y=x\)). این سیستم ها را سیستم های آزئوتروپی می گویند. در این حالت انحراف از حالت ایدال زیاد است که با توجه به نوع انحراف از حالت کامل، با دو نوع سیستم آزئوتروپی مواجه هستیم:
-
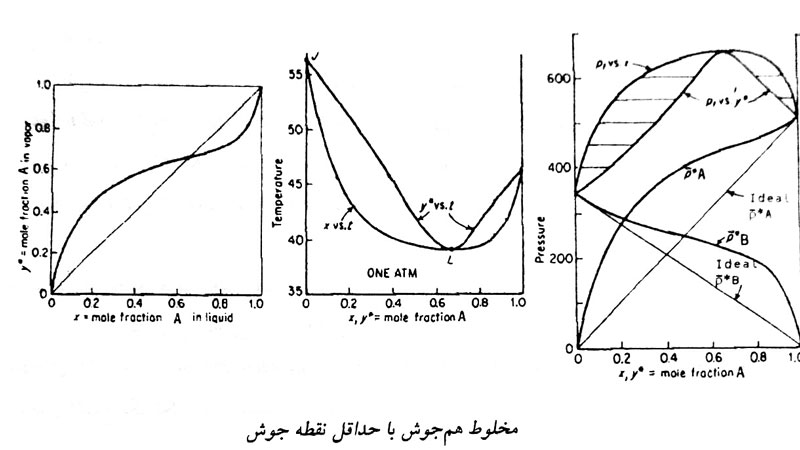
آزئوتروپ با نقطه جوش مینیمم (فشار ماکزیمم)
اگر در نقطه ای از منحنی \(P_{xy}\)، فشار کل مخلوط از فشار اشباع تک تک اجزاء بیشتر و یا در منحنی \(T_{xy}\)، دما از دمای اشباع تک تک اجزاء کمتر باشد، سیستم دارای آزئوتروپ با حداقل نقطه جوش (فشار ماکزیمم) است.
با توجه به منحنی \(T_{xy}\)، اگر سمت راست نقطه آزئوتروپ باشیم و مایع سرد را گرم کنیم در نهایت به ماده فرارتر خالص می رسیم که خلاف معمول است.
اگر طرف چپ نقطه آزئوتروپ باشیم، به ماده غیر فرار خالص به شکل مایع میرسیم. در نقطه آزئوتروپ مخلوط بدون آنکه تغییری در ترکیب نسبی آن ایجاد شود، می جوشد.
آزئوتروپ با نقطه جوش مینیمم
نکته: چون در نقطه آزئوتروپ \( \alpha =1\) است، اجزاء مخلوط هایی از این نوع را نمی توان به روش تقطیر معمولی از هم جدا کرد. در بعضی موارد با تغییر فشار هم جوشی (آزئوتروپ) را از بین می برند.
با توجه به منحنی \( xy \) در فشار ثابت، قبل از نقطه آزئوتروپ y بزرگتر از x و پس از این نقطه x بزرگتر از y می باشد.
نکته: در محلول هایی که در طرف راست نقطه آزئوتروپ هستند، \( \alpha\) محاسبه شده معمولا کوچک تر از واحد است. در این حالت از عکس \( \alpha \) استفاده می شود.
نکته: اگر فشار کل واقعی در یک نقطه از فشار اشباع تک تک اجزاء بیشتر باشد، سیستم حتما دارای آزئوتروپ می باشد، ولی ممکن است نقطه مورد نظر نقطه آزئوتروپ نباشد.
نکته: اگر در درصد ترکیبی از مخلوط فشار کل واقعی کمتر از فشار اشباع جز فرارتر و بیشتر از فشار اشباع جز غیر فرارتر باشد، مشخص نیست سیستم آزئوتروپ دارد یا نه، زیرا امکان وجود آزئوتروپ در ترکیب درصد دیگری وجود دارد.
نکته: در نقطه آزئوتروپ داریم:
\( \frac{\partial P_t}{\partial x}=0 \)
\( \frac{\partial P_t}{\partial y}=0 \)
بنابراین محصول ایدال هیچ وقت تشکیل آزئوتروپ نمی دهد.
نکته: یکی از مهمترین این مخلوط ها، آب و اتانول است که نقطه هم جوشی آنها در فشار اتمسفر، دمای 78.2 درجه سلسیوس، جز مولی 0.894 و جز جرمی 0.965 است. با کاهش فشار تا 70mmHg نقطه همجوشی این مخلوط حذف می شود.
-
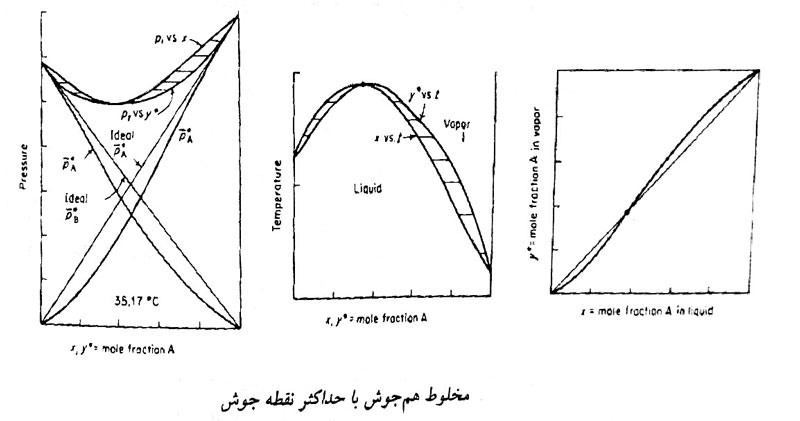
آزئوتروپ با نقطه جوش ماکزیمم (فشار مینیمم)
اگر در نقطه ای از منحنی \(P_{xy}\)، فشار کل مخلوط از فشار اشباع تک تک اجزاء کمتر و یا در منحنی \(T_{xy}\)، دما از دمای اشباع تک تک اجزاء بیشتر باشد، سیستم دارای آزئوتروپ با حداکثر نقطه جوش (فشار مینیمم) است.
با توجه به منحنی \( xy \) در فشار ثابت، قبل از نقطه آزئوتروپ x بزرگتر از y و پس از این نقطه y بزرگتر از x می باشد.
آزئوتروپ با نقطه جوش ماکزیمم
در این حالت اگر مخلوط درون ظرف درباز را حرارت دهیم در نهایت مایعی با ترکیب نسبی نقطه آزئوتروپ در ظرف باقی می ماند.
نکته: آزئوتروپ با نقطه جوش مینیمم، در سیستم هایی که دارای ازئوتروپ باشند بیشتر رخ می دهد.
نکته: یکی از معروفترین مخلوط هایی که دارای آزئوتروپ با نقطه جوش ماکزیمم است، اسید کلریدریک و آب است. از این خاصیت در استاندارد کردن اسید کلریدریک استفاده می شود.
نکته: از مخلوط شدن هیدروکربنهایی با ساختمان مولکولی متفاوت، اغلب محلول های غیر کامل همراه با هم جوشی حاصل می شود (مانند هگزان- بنزن).








2 دیدگاه
محمد
بسیار عالی بود ممنون
مدیریت سایت
لطف دارید به ما