ابعاد سرعت واکنش
در یک واکنش متجانس از درجه n ابعاد ثابت سرعت k به صورت زیر خواهد بود:
\([k]=\text{(زمان)}^{-1}\text{(غلظت)}^{1-n}\)
برای مثال برای واکنش درجه صفر:
\([k]=\text{(زمان)}^{-1}\text{(غلظت)}^{1}\)
اگر غلظت را بر حسب \(mol/lit\) و زمان را بر حسب ثانیه بیان کنیم:
\([k]={mol \over {lit.sec}}\)
بنابراین از روی ابعاد ثابت سرعت می توان درجه واکنش را مشخص کرد.
وابستگی سرعت واکنش به دما
در اکثر واکنشها با افزایش دما، سرعت واکنش زیاد می شود و در دماهای معمولی به ازای هر ۱۰ درجه افزایش دما، سرعت واکنش ۲ برابر یا بیشتر می شود.
توجه داشته باشید که در واکنش های آنزیمی با افزایش دما، سرعت واکنش ابتدا افزایش یافته و سپس کاهش می یابد و در واکنش های انفجاری با افزایش دما، سرعت واکنش ابتدا افزایش یافته و سپس ثابت می ماند.
چنانچه اشاره کردیم در معادله سرعت واکنش، عاملی که تغییرات دما را نشان می دهد ثابت سرعت واکنش است. در بخش های بعدی وابستگی ثابت سرعت واکنش را به دما در سه نظریه یعنی نظریه آرنیوس، نظریه برخوردها و نظریه حالت گذرا مورد بررسی قرار میدهیم.
1- نظریه آرنیوس (arrhenius theory)
معادله آرنیوس که برای بیان وابستگی ثابت سرعت به دما بیان می شود به صورت زیر است
\( k=Ae^{-E/RT}\)
در معادله فوق A را ضریب پیش نمایی می نامند و واحد آن با واحد ثابت سرعت یکسان است. E هم انرژی فعالسازی است که واحد آن با واحد RT یکسان و از لحاظ عددی همواره مثبت است. A و E هر دو مستقل از دما در نظر گرفته می شوند.
هرکه محدوده تغییرات دمایی بسیار وسیع نباشد می توان با تقریب خوبی از معادله آرنیوس استفاده کرد.
از لحاظ فیزیکی می توان معادله آرنیوس را چنین تفسیر کرد که مولکولها برای ترکیب شدن با یکدیگر باید دارای انرژی کافی باشند تا بتوانند از قله انرژی عبور کنند در معادله آرنیوس \( e^{-E/RT}\) نشانگر کسری از مولکولها است که دارای این حداقل انرژی (E) هستند و ضریب پیش نمایی A هم به تعداد برخوردهای انجام شده از جهات مناسب در واحد حجم اشاره می کند. با توجه به معادله آرنیوس داریم:
\( k={Ae^{-E/RT}} \Rightarrow lnk={lnA-{E \over RT}}\)
یعنی منحنی تغییرات \(lnk\) با \(1 \over T\) به صورت خطی است که دارای شیب \(-E \over R\) و عرض از مبدأ \(lnA\) است.
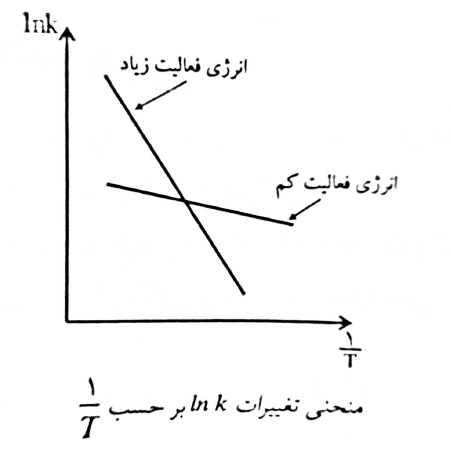
منحنی آرنیوس
بنابراین واکنش های دارای انرژی فعالیت بالا حساسیت زیادی در برابر تغییرات دما دارند و بالعکس واکنش های با انرژی فعالیت پایین در مقابل تغییرات دما حساس نیستند.
در دماهای پایین حساسیت واکنش به دما بسیار بیشتر از حساسیت آن در دماهای بالا است.
حال اثر دما را بر روی یک واکنش مورد بررسی قرار می دهیم، فرض کنید بخواهیم واکنش تا حد مشخصی پیش برود، هرگاه دما \(T_1\) باشد زمان رسیدن به این حد \(t_1\) و اگر دما \(T_2\) باشد زمان لازم \(t_2\) است در این صورت رابطه زیر را خواهیم داشت:
\({t_1 \over t_2}={k_2 \over k_1}={exp[-{E \over R}({1 \over T_2} – {1 \over T_1})]}\)
معادله آرنیوس برای واکنش های درجه اول بدون نفوذ و مقاومت های گرمایی نتایج خوبی می دهد اما در برخی موارد صادق نیست. مثلا در حالتی که واکنش چند مرحله ای باشد و یا مکانیسم واکنش با تغییر دما تغییر کند که در این صورت از معادلات دیگری به شکل \( k=BT^me^{-E/RT}\) استفاده می شود.
2- نظریه برخوردها (collision theory)
فرضیات مهمی که در نظریه برخوردها در نظر گرفته می شود عبارتند از:
- مولکولها به شکل کرات صلب فرض می شوند.
- برای انجام واکنش، برخورد بین دو مولکول ضرورت دارد.
- همه برخوردها به واکنش نمی انجامند و تنها برخوردهایی به واکنش ختم می شوند که دارای حداقل انرژی برابر با انرژی فعالسازی باشند.
- سرعتهای مولکولی طی واکنش از تابع توزیع بولتزمن پیروی می کنند.
براساس این نظریه تعداد مولکولهای محصول به ازای واحد زمان در واحد حجم (یا به عبارت دیگر سرعت واکنش) متناسب است با تعداد برخوردها
در این نظریه تغییرات ثابت سرعت با دما به شکل زیر بیان می شود:
\( k=\alpha T^{1 \over 2}e^{-E/RT}\)
نکته: برای بسیاری از واکنشهای شیمیایی سرعتهای پیش بینی شده از نظریه برخوردها بزرگتر از مقادير تجربی است.
3- نظريه حالت گذرا (transition state theory)
واکنش را در نظر میگیریم. در نظریه گذرا دو فرضیه اساسی داریم که عبارتند از:
- در این واکنش موادی حاصل می شوند که پیکربندی اتم های تشکیل دهنده آنها طوری است که می توانند به صورت خود به خود به مواد اولیه تبدیل شده و یا در جهت تولید به محصولات واکنش تبدیل شوند.
- مواد تشکیل شده در حالت گذرا با واکنشگرها دارای تعادل موثری هستند.
نکته: مواد ناپایدار تشکیل شده دارای غلظت بسیار ناچیزی نسبت به مواد واکنش دهنده هستند.
ویژگی های نظریه گذرا
- هم برای واکنش های یک فازی به کار می رود و هم دوفازی
- این نظریه برای واکنش های دو مولکولی مفیدتر است.
در نظریه برخوردها تغییرات ثابت سرعت واکنش با دما به شکل زیر بیان می شود:
\( k=\alpha Te^{-E/RT}\)
بنابراین در کل می توان چنین گفت که اگر تغييرات ثابت سرعت واکنش با دما را به صورت \( k=\alpha T^ne^{-E/RT}\) در نظر بگیریم، داریم:
1) نظریه آرنیوس : \(n=0\)
2) نظریه برخورد ها: \(n={1 \over 2}\)
3) نظریه حالت گذرا: \(n=1\)
نکته: با توجه به معادله سرعت می توان فهمید نظریه برخورد ها صادق است یا نظریه حالت گذرا
الف) اگر در معادله سرعت تنها غلظت مواد اولیه موجود باشد، نظریه برخورد ها صادق است.
ب) اگر در معادله سرعت تنها غلظت محصولات موجود باشد، نظریه حالت گذرا صادق است.
نکته: در نظریه برخورد ها تولید ماده میانی محدود کننده واکنش است اما در نظریه حالت گذرا مصرف ماده میانی محدود کننده سرعت واکنش است.