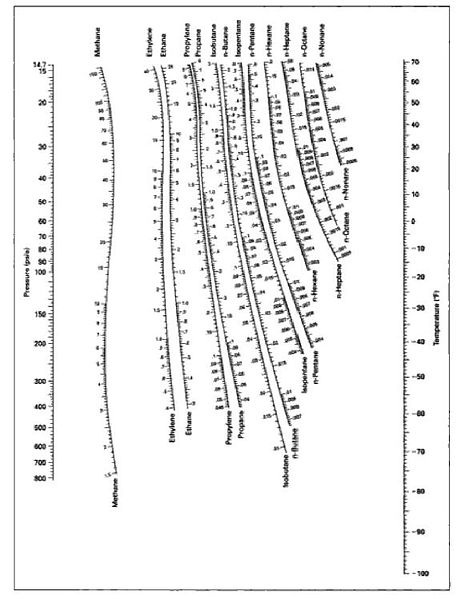
نمودار DePriester برای محاسبه تعادلهای فازی هیدروکربنها
جهت محاسبات درس ترمودینامیک و محاسبات تعادلهای فازی هیدروکربنها می توان از نمودار DePriester برای به دست آوردن ثوابت تعادل استفاده نمود. در واقع يكي از منحني هاي پركاربرد در محاسبات تعادلي هيدروكربورها منحني دپريستر مي باشد.برای یک سیستم گازی با T و P مشخص می توان ضریب توزیع K-Value هیدروکربن های مختلف را با استفاده از نمودار Depriester به دست آورد.
در یک سیستم چند جزیی، نسبت تعادل Ki یک جزء معین به صورت نسبت کسر مولی آن جزء در فاز گازی y i به کسر مولی آن در فاز مایع x i تعریف می شود:
Ki = yi / xi
Ki نسبت تعادل جزء i ام؛
yi کسر مولی جزء i ام در فاز گازی؛
xi کسر مولی جزء i ام در فاز مایع.
در فشارهای زیر 100psia , قوانین رائولت و دالتون ابزاری ساده برای پیش بینی نسبتهای تعادل محلولهای ایده آل اند. قانون رائولت بیان می کند که فشار جزیی Pi یک جزء در یک سیستم چند جزیی برابر حاصلضرب کسر مولی اش در فاز مایع xi در فشار بخار ان جز pvi است:
pi = xi* pvi
pi فشار جزیی جزء i ام psia،
pvi فشار بخار جزء i ام، psia ؛
xi کسر مولی جزء i ام در فاز مایع.
قانون دالتون بیان میکند که فشار جزیی یک جزء برابر حاصلضرب کسر مولی اش در فاز گازی yi در فشار کل سیستم p است :
pi = yi* p
p فشار کل سیستم است.
در حالت تعادل و در توافق با این قوانین، فشار جزیی اعمال شدۀ یک جزء در فاز گازی باید برابر فشار جزیی اعمال شدۀ جزیی مشابه در فاز مایع باشد. بنابراین، با برابر قرار دادن معادلات توصیف کنندۀ دو قانون:
xi* pvi = yi* p
با آرایش مجدد رابطۀ بالا و با استناد به مفهوم نسبت تعادل:
yi / xi = pvi / p = Ki
این معادلۀ نشان می دهد که برای محلول های ایده ال بدون توجه به ترکیب کلی مخلوط هیدروکربنی نسبت تعادل تنها تابعی از فشار سیستم p و دمای سیستم T است زیرا فشار بخار یک جزء تنها تابعی از دماست.
در این پست نمودار Depriester برای هیدروکربن های مختلف در دماها و فشار های مختلف جهت دانلود قرار داده شده است.